節錄自台灣醫藥品法規學會官網
依據「醫療器材管理法」條文共 85 條,有以下六大管理重點
涵蓋 產品實現、管理責任、品質管理、資源管理、量測分析與改善,
本次先就 [強化上市後醫療器材安全監督管理] 說明
1. 促進產業技術研發及產品創新:
將從事醫療器材「設計」並以其名義上市者,納入為醫療器材製造業,鼓勵產業研發及產品創新。精進醫療器材加速上市及配套機制之法源依據,以嘉惠病患。
2. 多元化科技產業管理:
納入醫療器材維修業者管理,及規範特定醫療器材之販售及供應型態。
3. 來源及流向追蹤管理:
完善醫療器材業者管理制度,規範醫療器材製造與販賣業者管理、產品來源流向建立、製造品質管理系統要求及運銷管理之規定。
4. 落實產品風險分級管理:
部分低風險之醫療器材由查驗登記制度改採電子化線上登錄制度,並以年度申報延續登錄效力。
5. 通報制度:
為保護受試者權益,規範醫療器材臨床試驗之管理,試驗施行期間發生與臨床試驗有關之不良情事,皆應通報,施行期間有安全之虞,得中止或終止臨床試驗,並為落實風險管理,明定執行經公告無顯著風險之醫療器材臨床試驗無需申請主管機關核准。
6. 強化上市後醫療器材安全監督管理:
確保市售醫療器材之品質與安全,部分特定高風險醫療器材須執行安全監視,醫事機構應協助配合辦理,並賦予業者主動監控上市後產品之風險管理,並進行必要矯正預防措施
法源:
8.5.2糾正措施
8.5.3預防措施。
8.5.2糾正措施
1.增加及時採取糾正措施 2.增加驗證糾正措施
1.組織應採取措施,以消除不合格的原因,防止不合格的再發生,並且應及時採取任何必要的糾正措施;
2.糾正措施應與所遇到的不合格的程度相適應;
3.驗證糾正措施會否對適用的法規要求或醫療器械的安全和性能帶來不利影響。
4.任何調查和採取措施的記錄應予保持。
8.5.3預防措施
1.增加對措施形成檔的要求 2.增加驗證預防措施的要求 3.增加記錄的要求
1.策劃並對所需的措施形成檔,實施措施,適當時,包括更新檔;
2.驗證糾正措施未對滿足適用的法規要求的能力和醫療器械的安全和性能帶來不利影響;
3.任何調查和採取措施的記錄應予保持。
預防措施是指消除潛在不合格的原因所採取的措施。與糾正措施不同,潛在不合格指現在尚未發生的但有可能發生的不合格。
涵蓋職能:
橫跨 研發、品管、製造、入庫、銷售、服務各主要職能 ,可說涵蓋全公司組織
作法簡述:
- 建立事件處理團隊,應涵蓋 研發、採購、製造、品管、倉管
- 針對已發生和有可能發生的事項
事先建立當事件發生時以降低或消除事故擴大為目的預計的風險管理對應方法和流程
3) 消除已發生的不合格、
4) 防止已經發生的不合格再次發生、
5) 進而建立消除潛在不合格的原因所採取的措施
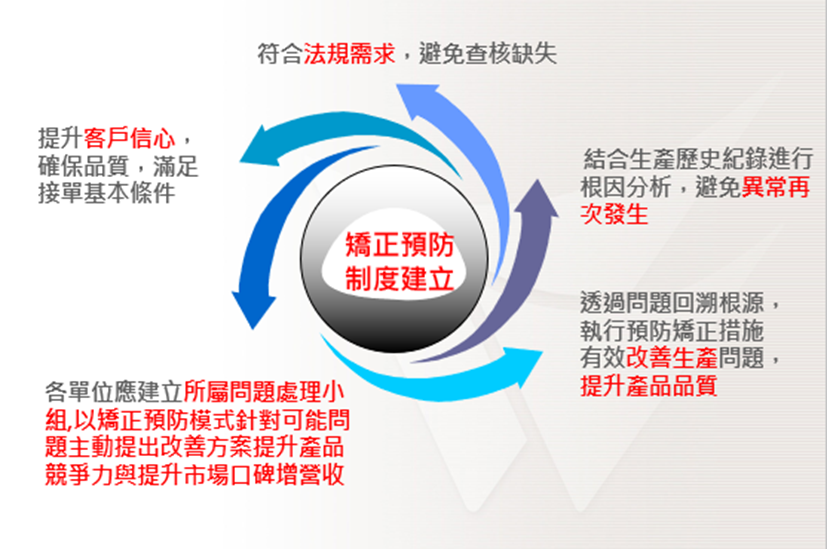
目的與效益如下圖所示: